Meine erste Berührung mit einem Mikroskop hatte ich in der Schule. Im Fach Bio-Chemie behandelten wir verschiedene Insekten und untersuchten deren Anatomie. Schon aus der Nähe betrachtet waren diese Tierchen beeindruckend – wie viel beeindruckender war es jedoch, sie durch ein Mikroskop zu betrachten! Die feinen Härchen auf den Beinen oder die filigrane Struktur ihrer Flügel wirkten durch ein Okular betrachtet noch einmal viel imposanter, schließlich konnten wir so viel mehr Details erkennen. Später widmeten wir uns den Pflanzen, sezierten Zwiebeln und zeichneten die Zellen nach. Mithilfe eines Mikroskops konnten wir sogar die Zellkerne erkennen. Faszinierend!

Quelle: “Olympus CH2 microscope” von Amada44, Wikipedia, CC-BY-SA 3.0
Damals hatte ich ein klares Bild von einem Mikroskop im Kopf: Es hatte ein Objektiv, ein Okular, irgendwo konnte man die Probe platzieren und mit einer Lampe bescheinen. Die von uns untersuchten Objekte konnten wir mit solch einem Instrument gut beobachten. Schließlich saßen die Härchen der Heuschrecke auf der Oberfläche ihrer Beine, die Zellen der Zwiebelmembran waren so gut wie durchsichtig. Die Lampe konnte diese Strukturen gut ausleuchten, sodass das Bild hell genug war. Was aber, wenn wir andere Dinge hätten untersuchen wollen, wo eine Lampe nicht so ohne Weiteres hin scheinen kann? Beispielsweise Neuronen innerhalb eines Gehirns?
Viele Jahre hatte ich nichts mehr mit Mikroskopen zu tun. Bis ich für meine Masterarbeit in eine Arbeitsgruppe kam, die sich mit der Entwicklung und dem Bau spezieller Mikroskope beschäftigt. Inzwischen habe ich dort während meiner Doktorarbeit ein solches Mikroskop selbst entwickelt. Warum wir nicht einfach ein „normales“ Mikroskop verwendet? Was muss denn da noch entwickelt und gebaut werden? Dazu muss man wissen, dass Mikroskop nicht gleich Mikroskop ist: Es gibt unzählige Techniken. Zum Beispiel sind da die Hellfeldmikroskopie, die Dunkelfeldmikroskopie, die Phasenkontrastmikroskopie, die Elektronenmikroskopie oder die Fluoreszenzmikroskopie. Ganz schön viele? Alle diese Techniken lassen sich in unzählige weitere Spezifikationen unterteilen. Bevor uns jetzt der Kopf schwirrt, schauen wir uns eine Anwendung mal genauer an:
Stellen wir uns einmal vor, wir säßen in einem Flugzeug und blickten aus dem Fenster. Draußen ist es hell und wir sehen tief unter uns die Landschaft vorbeiziehen. Wir entdecken eine Stadt mit vielen Häusern, vielleicht können wir auch ein paar Straßen erahnen. Aber alles ist winzig klein, weil es so weit weg ist, und um welche Stadt es sich handelt, können wir vielleicht nur erraten, weil die Bauwerke und Straßen in einer einzigen grauen Landschaft kaum voneinander unterschieden werden können. Nun stellen wir uns die gleiche Situation vor, aber diesmal ist es Nacht. Die Landschaft liegt dunkel unter uns, wir können kaum den Übergang zwischen Erde und Himmel ausmachen. Doch dort liegt eine Stadt: Wir erkennen ganz genau die Straßenverläufe, weil die Straßenlaternen und die Autoscheinwerfer hell leuchten. Vielleicht erkennen wir auch ein besonderes Gebäude, weil es von Scheinwerfern angestrahlt wird. Anhand der Straßenanordnung und der markanten Gebäude können wir erkennen, um welche Stadt es sich handelt.

Moskau bei Tag 
Moskau bei Nacht
Quelle: NASA/METI/AIST/Japan SPace Systems, and U.S./Kapan ASTER Science Team
Moskau bei Nacht: Die Straßen sind erleuchtet und heben sich klar von der Umgebung ab.
Quelle: ISS038-E-041160
Was hat das jetzt mit Mikroskopie zu tun? Nun, dieses Prinzip nutzen wir in der sogenannten Fluoreszenzmikroskopie. Fluoreszenz ist ein Phänomen, bei dem bestimmte Moleküle in der Lage sind, Licht auszustrahlen. Das tun sie nicht einfach so, sondern nur, wenn sie mit Licht einer ganz bestimmten Wellenlänge angestrahlt werden. Jedes fluoreszierende Molekül ist in der Regel „empfänglich“ für eine bestimmte Wellenlänge, die in eine Lichtfarbe übersetzt werden kann. Scheinen wir zum Beispiel mit einem grünen Laserstrahl auf solch ein Molekül, dann nimmt dieses die Energie des Lichtes auf und strahlt wiederum Licht mit einer anderen Farbe ab, zum Beispiel rot. In der Fluoreszenzmikroskopie nutzen wir dieses Phänomen, um ganz spezielle Strukturen sichtbar zu machen.
Nehmen wir an, wir möchten uns eine bestimmte Region im Gehirn (z.B. einer Maus) einmal genauer anschauen. Im Gehirn liegen unglaublich viele Neuronen, die miteinander verbunden sind, dicht an dicht. Dazwischen befinden sich Blutadern und andere Strukturen, die uns zunächst nicht interessieren. Wir möchten gerne wissen, wie viele solcher Neuronen dort zu sehen sind und wie sie untereinander vernetzt sind. Würden wir eine dünne Scheibe eines Gehirns unter ein Mikroskop legen, wie ich es damals in der Schule benutzt habe, würde die Lampe kaum durch die Scheibe hindurch scheinen können – wir würden nur eine graue Masse sehen. Die Fluoreszenz kann uns hierbei helfen: Die Neuronen in der Hirnscheibe werden so präpariert, dass sie zu fluoreszieren, also zu leuchten beginnen, wenn wir sie mit einem bestimmten Laser bestrahlen. Alles andere, was in dieser Hirnscheibe vorliegt, zum Beispiel die Blutadern, fluoresziert nicht. Auf diese Weise können wir mit der Fluoreszenzmikroskopie die Neuronen sichtbar machen, während der Rest des Hirnschnitts dunkel bleibt. Für uns Menschen ist es viel einfacher, ein helles Signal von einem schwarzen Hintergrund zu unterscheiden, anstatt in einer komplett hellen Umgebung die eine Struktur von der anderen zu trennen – ähnlich wie die hell erleuchteten Straßen einfach zu unterscheiden sind von den dunklen Häusern.
Jetzt aber zurück zu meiner Doktorarbeit: Ich wollte Neuronen in Maushirnen sichtbar machen, um daraus Schlüsse ziehen zu können, wie Informationen im Gehirn verarbeitet werden. In einem Gehirn liegen dicht an dicht Milliarden von Neuronen. Wenn wir die alle zum Leuchten anregen würden, wäre das zwar schön hell, aber die Verbindung zwischen einzelnen Neuronen könnten wir nicht mehr gut erkennen. Wir würden den Wald vor lauter Bäumen nicht mehr sehen! Darum habe ich eine spezielle Art von Fluoreszenzmikroskop gebaut, welche nur eine dünne Scheibe in der Probe zum Leuchten anregt: Ein Lichtscheibenmikroskop. Dabei wird ein Laserstrahl mithilfe eines kippbaren Spiegels sehr schnell hin- und herbewegt; wir sagen, er wird „gescannt“. Das geschieht innerhalb weniger Millisekunden. Über die Zeit gemittelt entsteht dabei eine Lichtscheibe, die so dünn ist wie der Laserstrahl. In meinem Fall war die Lichtscheibe wenige Mikrometer dick. Damit war ich also in der Lage, nur die Neuronen innerhalb der wenige Mikrometer dicken Lichtscheibe zur Fluoreszenz anzuregen – der Rest blieb dunkel. Mit einem Objektiv habe ich dann von oben auf dieses Lichtblatt geschaut und das Fluoreszenzlicht der Neuronen aufgefangen. Solch ein Objektiv hat eine gewisse fokale Länge, was bedeutet, dass es nur Strukturen in einer gewissen Entfernung scharf abbilden kann. Alles, was vor oder hinter der fokalen Länge liegt, sieht für den Betrachter verschwommen aus. Wenn man nun das Objektiv so weit vom Lichtblatt entfernt positioniert, dass dieses mit der fokalen Länge zusammenfällt, kann man die fluoreszierenden Neuronen scharf abbilden. Alles andere in der Probe, was sowieso nicht scharf abgebildet werden könnte, bleibt dunkel und „stört“ das Bild nicht durch helles Hintergrundlicht.
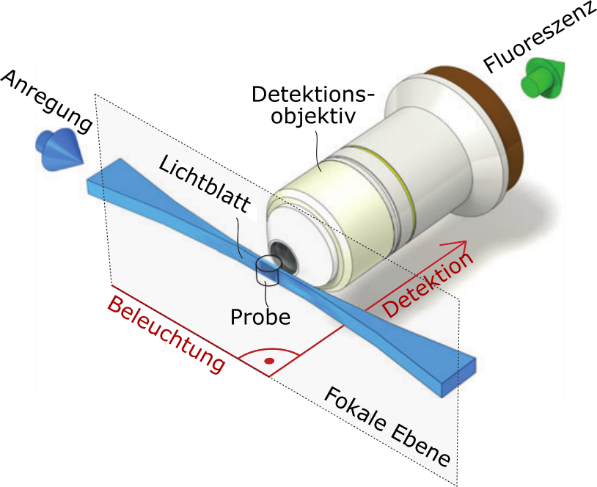
Mit einem Lichtscheibenmikroskop kann man nicht nur zweidimensionale Bilder von Neuronen aufnehmen, sondern sogar in drei Dimensionen ganze Volumen in einem Maushirn abbilden. Dazu haben wir die Maushirnscheibe nach und nach durch das Lichtblatt geschoben und im Abstand von wenigen hundert Nanometern jeweils ein Bild aufgenommen. Setzt man diese Bilder anschließend zusammen, erhält man ein 3D-Bild des aufgenommenen Volumens. Gemeinsam mit meinen Kolleginnen und Kollegen habe ich erste Ergebnisse in einem wissenschaftlichen Artikel veröffentlicht; aus diesem Artikel stammen auch die Abbildungen in diesem Blog [2].

Wir waren in der Lage, einen Teil des Hippocampus abzubilden, der Hirnregion, die das explizite Gedächtnis formt. Innerhalb dieser großen Hirnregionen war die Auflösung gleichzeitig so hoch, dass wir einzelne Synapsen sichtbar machen konnten.
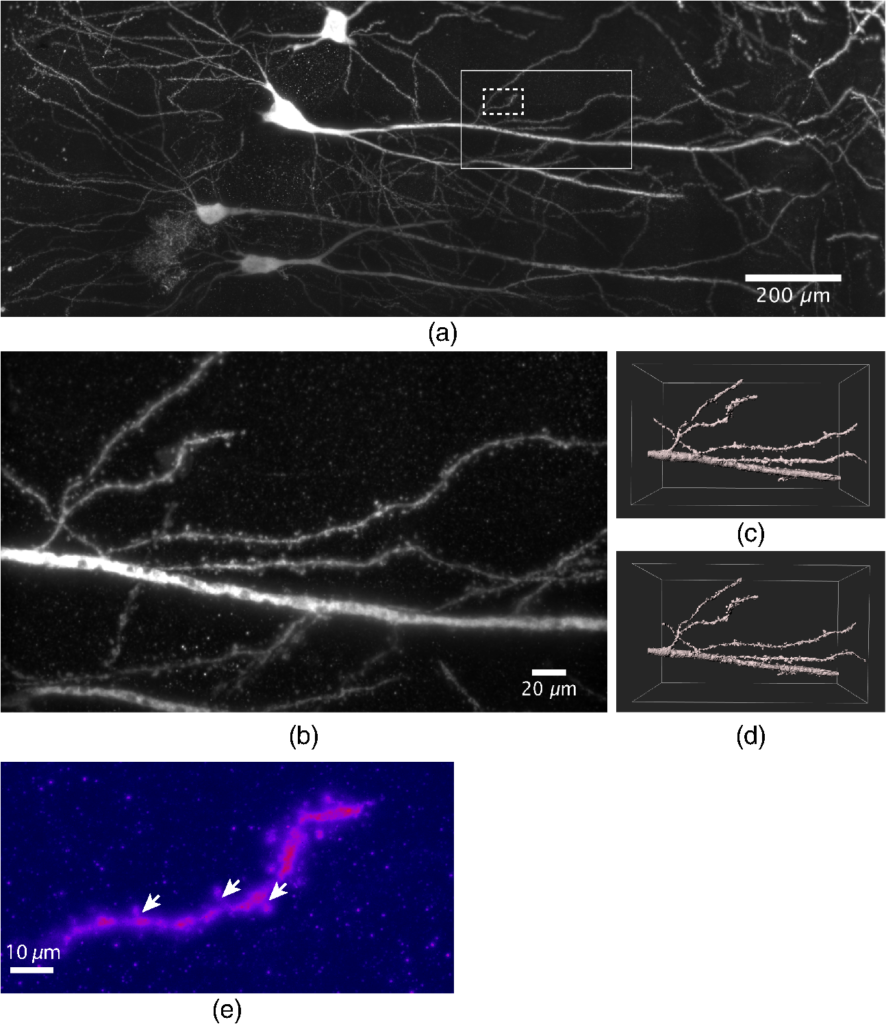
Das Lichtscheibenmikroskop bildete die Grundlage meiner Doktorarbeit. Mit diesem Gerät habe ich spezielle Proben – Maushirnschnitte mit einer besonderen Fluoreszenzmarkierung – aufgenommen und anschließend analysiert, wofür ich eine eigene Analysesoftware programmiert habe. Was es mit dieser Fluoreszenzmarkierung auf sich hatte und wie die Analyse der Bilder aussah? Das soll Thema eines nächsten Blogeintrags sein.
Quellen:
[1] J. Huisken et al., Selective plane illumination microscopy techniques in developmental biology, Development(2009)
[2] J. Bürgers et al., Light-sheet fluorescence expansion microscopy: fast mapping of neural circuits at super resolution, Neurophotonics (2019)